7月8日訊 為推動藥品專利鍊接制度落地,最高法自7月5日起施行《關于審理申請注冊的藥品相關的專利權糾紛民事案件适用法律若幹問題的規定》這一司法解釋,為國家藥監局、國家知識産權局發布的《藥品專利糾紛早期解決機制實施辦法(試行)》完善司法銜接。
國家層面最近密集對專利保護出台了相應政策法規,以促進創新藥、仿制藥的高質量發展。隻不過,相較于創新藥而言,在國采、一緻性評價等政策合力下,仿制藥市場大幅縮水讓仿藥立項的機會更加受業界關注。夾縫中找機會,機會何在?前述一系列專利保護新機制支了大招:新政按程序對相關化學仿制藥注冊申請設置9個月等待期,對首個挑戰專利成功并首個獲批上市的化學仿制藥給予12個月市場獨占期。
鼓勵挑戰專利,支持首仿,國内仿制藥或将迎來新的競争格局。
之所以說立項也是一種能力,主要是因為仿制藥市場發生着巨變。
第五批國采塵埃落地,但仿制藥市場的總體縮水已是不可逆轉的趨勢。梳理前幾輪國采的實際情況,有機構進行了粗略統計,僅
醫院終端,第一輪國家集采中選的25個品種2020年總銷售額為292.50億元,與2018年的547.44億元相比,市場規模萎縮46.57%,總銷量則從83.05億劑增至99.48億劑,增長19.78%。其中,原研藥總銷售額從297.60億元下降至140.47億元,總銷量從28.30億劑下降至19.48億劑;仿制藥總銷售額則從267.84億元下降至152.03億元,總銷量從54.75億劑上升至80.01億劑,仿制藥處方率從65.82%上升至80.42%。這組數據雖然說明了仿制藥替代效應明顯,但可以看到,總體量大幅縮水。由此需要深思的是,仿藥立項未來究竟機會何在?
這是一個更值得思考的問題,很多人把仿制藥立項稱為在狹縫中找機會。
上述專利政策法規的建立、完善,包括藥品專利鍊接制度的早期解決機制,既有利于原研藥企業,也會促進原研藥和仿制藥的良性發展。尤其是,對首個挑戰專利成功并首個獲批上市的化學仿制藥,給予市場獨占期。市場人士指出:“雖說就首仿藥而言,此前的文件及相關政策均有鼓勵,尤其是挑戰專利,不少企業都取得了很好的成績,在醫保支付等環節也有一定的傾斜。不過,從法律法規的角度來說,仿制藥做一緻性評價投入很大,專利文件規定了12個月獨占期,對頭部具有研發能力的企業發展高質量仿制藥具有積極作用,對手握多個首仿藥的本土藥企是利好。法律層面厘清了,企業就好專注于技術創新。”
客觀來講,藥品專利一直是業界非常糾結的話題。有報告顯示,僅2017-2019年,就有跨國藥企的38款原研藥物在中國被提起專利權無效請求,已作出的審查決定中全部無效33件(占55%),部分無效20件(占33%),維持有效7件(占12%)。2020年約18款跨國藥企原研藥品相關的24件專利遭到中國藥企或機構提出專利挑戰,涉及國家知識産權局作出的26項決定号,全部無效決定占54%。
從當前仿制藥的競争環境來分析,仿制藥立項将更注重低成本的技術比較優勢。有兩點顯得格外重要:一是原料藥是否可及。這是産生成本優勢的基礎;二是技術轉化速度。不少頭部企業選擇小衆領域精選立項,如吸入制劑、緩控釋制劑等領域很受歡迎。這些歸根到底考驗的就是企業的産品結構及梯隊布局,搶占首仿藥市場就是立項能力的體現。
搶先機!頭部企業競跑
仿制藥機會究竟在哪裡?頭部企業用行動給出了答案。
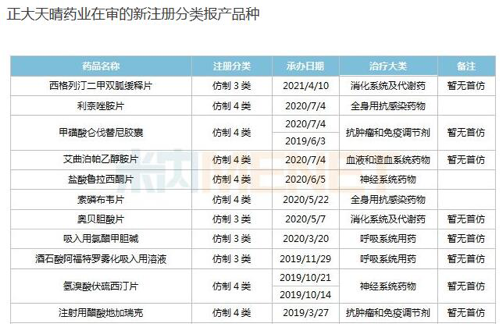
正大天晴就是名副其實的急先鋒。米内網數據庫顯示,從已過評和分類報産的仿制藥情況看,正大天晴目前有近20個品種首家過評,其中注射用唑來膦酸濃溶液、泊馬度胺膠囊、甲磺酸伊馬替尼膠囊等5個品種為獨家過評。
而目前其在審的新注冊分類報産仿制藥有20個,14個暫無首仿獲批。且看正大天晴瞄準的品種:甲磺酸侖伐替尼膠囊、依維莫司片、右蘭索拉唑腸溶膠囊等以新分類報産。而依維莫司、烏美溴铵維蘭特羅、氟替卡松維蘭特羅2020年全球銷售額分别為15.35億美元、5.47億英鎊、11.24億英鎊。
從這個維度看,恒瑞醫藥的布局也顯得精巧。3月3日,恒瑞醫藥的3類仿制藥托伐普坦片以首仿+首家過評的方式獲批生産,這是繼鹽酸右美托咪定氯化鈉注射液後,該公司今年獲批的第2款首仿。目前恒瑞有43個品種以新分類報産,其中15個已獲批生産并過評(含8個首仿);在審的28個品種中,有17個暫無首仿(含劑型首仿)獲批。
“巧”字體現在:如沙美特羅替卡松是由β2-激動劑及糖皮質激素組合而成的抗哮喘吸入劑,2013年達到52.74億英鎊的銷售峰值,2020年全球銷售額為15.35億英鎊;舒更葡糖鈉是全球首個選擇肌松拮抗劑,2020年全球銷售額為11.98億美元。14個品種由恒瑞醫藥首家/獨家以新分類報産,其中麥考酚鈉腸溶片已進入行政審批階段。
揚子江則選擇在神經系統藥物、全身用抗感染藥物等領域發力。此前,其首家以3類提交布立西坦注射液上市申請,該産品暫無仿制藥獲批。目前該公司有107個品種以新注冊分類報産。米内網數據顯示,2019年中國公立醫療機構終端全身用抗感染藥物、神經系統藥物市場規模分别突破2000億元、1000億元。揚子江在審的87個品種在2019年中國公立醫療機構終端銷售額合計銷售規模超過700億元,其中有22個在國内市場暫未有首仿獲批上市。
除普通制劑外,近些年由于緩控釋制劑臨床優勢明顯,行業内在制劑創新方面也突飛猛進。2020年中國公立醫療機構終端緩控釋制劑銷售規模接近300億元,如琥珀酸美托洛爾緩釋片、非洛地平緩釋片、格列齊特緩釋片、鹽酸坦索羅辛緩釋膠囊及二甲雙胍緩釋片等。其中硝苯地平控釋片銷售額突破50億元,琥珀酸美托洛爾緩釋片暫無首仿獲批。人福醫藥6款緩控釋制劑搶首仿,其中鹽酸他噴他多緩釋片、鹽酸氫嗎/啡/酮緩釋片首家或獨家報産。
《藥品專利糾紛早期解決機制實施辦法(試行)》
政策解讀
一、《
藥品專利糾紛早期解決機制實施辦法(試行)》起草背景是什麼?
藥品專利糾紛早期解決機制是指将相關藥品上市審批程序與相關藥品專利糾紛解決程序相銜接的制度。中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品
醫療器械創新的意見》《關于強化知識産權保護的意見》均提出要探索建立藥品專利鍊接制度。2020年10月,新修正的《中華人民共和國專利法》(以下簡稱《專利法》)第七十六條引入藥品專利糾紛早期解決的有關規定,明确由國務院藥品監督管理部門會同國務院專利行政部門制定藥品上市許可審批與藥品上市許可申請階段專利糾紛解決的具體銜接辦法,報國務院同意後實施。
為貫徹落實黨中央、國務院決策部署,推動建立我國藥品專利糾紛早期解決機制,國家藥監局、國家知識産權局會同有關部門在新修正的《專利法》相關規定的框架下,就藥品專利糾紛早期解決機制的具體制度認真研究,借鑒國際做法,在廣泛征求業界、協會、專家等意見并完善後,制定了《藥品專利糾紛早期解決機制實施辦法(試行)》(以下簡稱《辦法》)。
二、《辦法》目的和主要内容是什麼?
《辦法》旨在為當事人在相關藥品上市審評審批環節提供相關專利糾紛解決的機制,保護藥品專利權人合法權益,降低仿制藥上市後專利侵權風險。《辦法》的主要内容包括:平台建設和信息公開制度、專利權登記制度、仿制藥專利聲明制度、司法鍊接和行政鍊接制度、批準等待期制度、藥品審評審批分類處理制度、首仿藥市場獨占期制度等。
三、藥品專利糾紛早期解決的途徑有哪些?
《辦法》規定,專利權人或者利害關系人對四類專利聲明有異議的,可以就申請上市藥品的相關技術方案是否落入相關專利權保護範圍向人民法院提起訴訟或者向國務院專利行政部門請求行政裁決,即:司法途徑和行政途徑。在規定的期限内,專利權人可以自行選擇途徑。如果當事人選擇向國務院專利行政部門請求行政裁決,對行政裁決不服又向人民法院提起行政訴訟的,等待期并不延長。
專利權人或者利害關系人未在規定期限内提起訴訟或者請求行政裁決的,仿制藥申請人可以按相關規定提起訴訟或者請求行政裁決,以确認其相關藥品技術方案不落入相關專利權保護範圍。
四、藥品專利糾紛早期解決機制涵蓋的相關藥品專利有哪些?
可以在中國上市藥品專利信息登記平台中登記的具體藥品專利包括:化學藥品(不含原料藥)的藥物活性成分化合物專利、含活性成分的藥物組合物專利、
醫藥用途專利;中藥的中藥組合物專利、中藥提取物專利、醫藥用途專利;生物制品的活性成分的序列結構專利、醫藥用途專利。相關專利不包括中間體、代謝産物、晶型、制備方法、檢測方法等的專利。
五、如何進行專利聲明?
化學仿制藥申請人、中藥同名同方藥申請人、生物類似藥申請人提交藥品上市許可申請時,應當對照已在中國上市藥品專利信息登記平台公開的專利信息,針對被仿制藥每一件相關的藥品專利作出聲明。仿制藥申請被受理後10個工作日内,仿制藥申請人應當将相應聲明及聲明依據通知上市許可持有人。其中,聲明未落入相關專利權保護範圍的,聲明依據應當包括仿制藥技術方案與相關專利的相關權利要求對比表及相關技術資料。除紙質資料外,仿制藥申請人還應當向上市許可持有人在中國上市藥品專利信息登記平台登記的電子郵箱發送聲明及聲明依據,并留存相關記錄。
六、如何啟動等待期?
專利權人或者利害關系人對化學仿制藥注冊申請的四類專利聲明有異議的,可以自國家藥品審評機構公開藥品上市許可申請之日起45日内,就申請上市藥品的相關技術方案是否落入相關專利權保護範圍向人民法院提起訴訟或者向國務院專利行政部門請求行政裁決。專利權人或者利害關系人如在規定期限内提起訴訟或者請求行政裁決,應當自人民法院立案或者國務院專利行政部門受理之日起15個工作日内将立案或受理通知書副本提交國家藥品審評機構,并通知仿制藥申請人。收到人民法院立案或者國務院專利行政部門受理通知書副本後,國務院藥品監督管理部門對化學仿制藥注冊申請設置9個月的等待期。
對化學仿制藥申請人聲明中國上市藥品專利信息登記平台收錄的被仿制藥相關專利權應當被宣告無效的,如果專利權人或者利害關系人未就上市藥品的相關技術方案是否落入相關專利權保護範圍向人民法院提起訴訟或者向國務院專利行政部門請求行政裁決,不啟動等待期。
七、未早期解決專利糾紛的,相關藥品上市後如何處理?
未在中國上市藥品專利信息登記平台登記相關專利信息的,不适用本辦法;專利權人或者利害關系人未在規定期限内提起訴訟或者請求行政裁決的,不設置等待期。對此類未能早期解決專利糾紛的,相關藥品獲批上市後,如專利權人認為相關藥品侵犯其相應專利權,引起糾紛的,依據《中華人民共和國專利法》等法律法規的規定解決。已經依法批準的藥品上市許可決定不予撤銷,不影響其效力。



