國家藥監局發通知,全國醫療器械抽檢工作啟動,抽檢方案印發。
5月6日,國家
藥品監督管理局官網發布《國家藥監局綜合司關于印發2019年國家
醫療器械抽檢産品檢驗方案的通知》(下稱《通知》),向各省、自治區、直轄市藥品監督管理局印發2019年國家醫療器械抽檢産品檢驗方案。
這意味着,根據此前國家藥監局印發的《國家藥監局關于開展2019年國家醫療器械抽檢工作的通知》要求,2019醫療器械抽檢工作全面啟動。
國家藥監局在今日的《通知》中要求,各省自治區直轄市藥監局要按照《2019年國家醫療器械抽檢(中央補助地方項目)産品檢驗方案》、《2019年國家醫療器械抽檢(國家級預算項目)産品檢驗方案》組織相關檢驗機構按醫療器械強制性
标準以及經注冊或者備案的産品技術要求(注冊産品标準)開展檢驗工作。
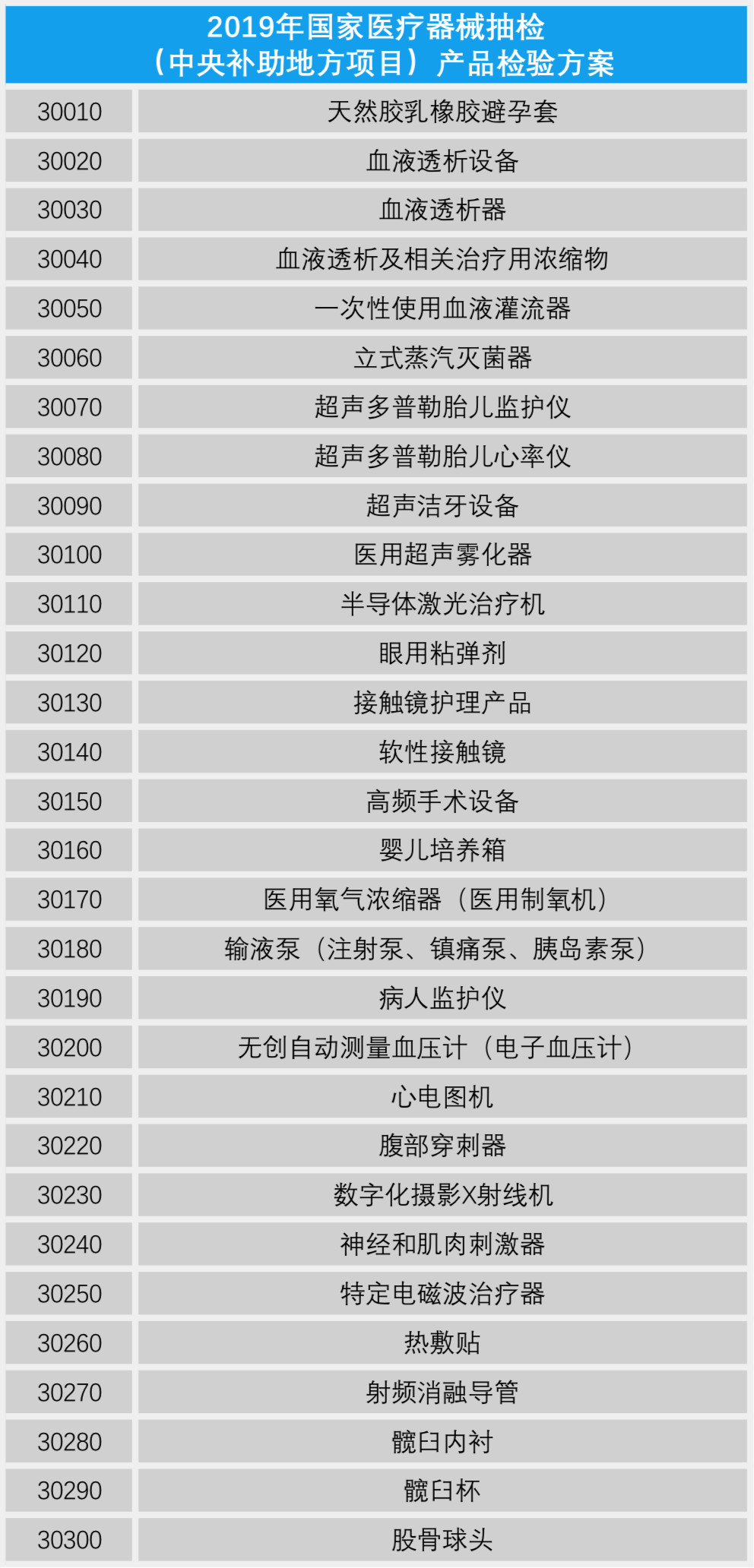
賽柏藍器械整理了上述兩個産品檢驗方案,共計59類醫療器械産品列入抽檢範圍,包括中央補助地方項目中的病人監護儀、心電圖機、腹部穿刺器和血糖儀等49類産品;以及國家級預算項目中的移動式X射線機和多類檢測試劑盒等10類産品。(具體産品詳見下文)
對于産品抽檢項目的判定原則,上述産品檢驗方案顯示,所抽檢項目任意項判定為不合格,則本次抽檢綜合結論為不合格。同時,樣品在正常檢驗過程中不能正常使用,本次抽檢綜合結論為不合格。
産品抽檢旨在加強上市後醫療器械産品的質量監管。據悉,2019年3月5日至7日,在廣州召開的2019年國家醫療器械抽檢工作座談會上,國家局醫療器械監管司司長王者雄表示,國家醫療器械抽檢工作還存在各種問題和挑戰,要求各單位精心組織、整合全國醫療器械抽檢資源,規範行為,狠抓嚴管,做好不合格産品召回信息發布及工作總結的報送工作。
此次國家藥監局的抽檢工作通知中也明确了複檢工作以及推薦複檢機構名單。(點擊文末閱讀原文獲取名單)
複檢工作上,被抽樣單位或标示生産
企業(下簡稱申請人)對檢驗結論有異議的,可以自收到檢驗報告之日起7個工作日内向相應的醫療器械檢驗機構提出複檢申請。為保證複檢效果,申請人可以優先從2019年國家醫療器械抽檢複檢機構推薦名單中選擇。複檢機構應及時受理複檢申請并開展檢驗工作。逾期未申請複檢的,視為申請人認可該檢驗結果,檢驗機構不再受理複檢申請。
同時,在異議申訴上,《通知》顯示,被抽樣單位或标示生産企業對檢驗方法、判定依據等存在異議,且無法通過複檢進行驗證的,應當自收到檢驗報告之日起7個工作日内,向所在地省局提出異議申訴書面申請,并提交相關證明材料。
所在地省局應當在收到申請後2個工作日内,将異議申訴情況填報至國家醫療器械抽檢信息系統,并在15個工作日内進行調查核實、确認核實結果,提出處理建議報中國食品藥品檢定研究院技術監督中心。相關省局未進行調查審核、未提出核實結果和處理建議的的,有關材料将予以退回。逾期未提出異議或者未提供有效證明材料的,視為申請人認可該檢驗結果。
附:
2019年國家醫療器械抽檢産品
來源:賽柏藍器械據國家藥監局官網整理