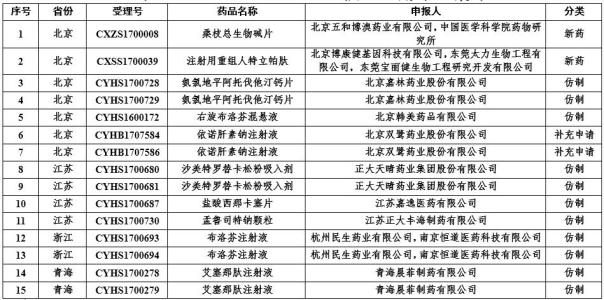
4月4日,國家藥監局發布《關于藥物臨床試驗數據自查核查注冊申請情況的公告(2019年第21号)》,決定對新收到的15個已完成臨床試驗申報生産的藥品注冊申請(見附件)進行臨床試驗數據核查。
公告顯示,在國家
藥品監督管理局組織核查前,
藥品注冊申請人自查發現藥物臨床試驗數據存在真實性問題的,應主動撤回注冊申請,國家藥品監督管理局公布其名單,不追究其責任。
國家藥品監督管理局食品藥品審核查驗中心将在其網站公示現場核查計劃,并通知藥品注冊申請人及其所在地省級藥品監管部門,公示期為10個工作日,公示期結束後,該中心将通知現場核查日期,不再接受藥品注冊申請人的撤回申請。并對進行核查中發現的數據造假的申請人、藥物臨床試驗責任人和管理人、合同研究組織責任人,國家藥品監督管理局将依法嚴肅處理。
根據名單,此次核查共涉及14家單位,包括嘉林藥業、雙鹭藥業、正大天晴、民生藥業、正大豐海制藥、晨菲制藥、嘉逸
醫藥等。
附15個藥物臨床試驗數據自查核查注冊申請清單