2月26日訊 首個國産美羅華,上市了!
2月25日,國家藥監局發布消息稱,首個國産生物類似藥利妥昔單抗獲批上市。
國家藥監局通知顯示,批準上海複宏漢霖生物制藥有限公司研制的利妥昔單抗注射液(商品名:漢利康)上市注冊申請。該藥是國内獲批的首個生物類似藥,主要用于非霍奇金淋巴瘤的治療。
▍什麼是生物類似藥
生物類似藥是指在質量、安全性和有效性方面與已獲準注冊的參照藥具有相似性的治療用生物制品。
國家藥監局表示,目前我國已成為生物類似藥在研數量最多的國家,先後有近200餘個生物類似藥臨床試驗申請獲得批準,部分産品已完成Ⅲ期臨床試驗并提交了上市注冊申請。
利妥昔單抗(美羅華),是由Genentech公司原研并由FDA批準的第一個用于治療癌症的單克隆抗體。此次複宏漢霖公司申報的利妥昔單抗注射液是國内首家以利妥昔單抗為參照藥、按照生物類似藥途徑研發和申報生産的産品,是第一個獲批上的國産美羅華。
國家藥監局根據《關于深化審評審批制度改革鼓勵藥品
醫療器械創新的意見》“支持生物類似藥、具有臨床價值的藥械組合産品的仿制”的要求,将該産品納入優先審評審批程序,在技術審評的同時,同步啟動生産現場檢查和檢驗工作,加快了該産品上市速度。
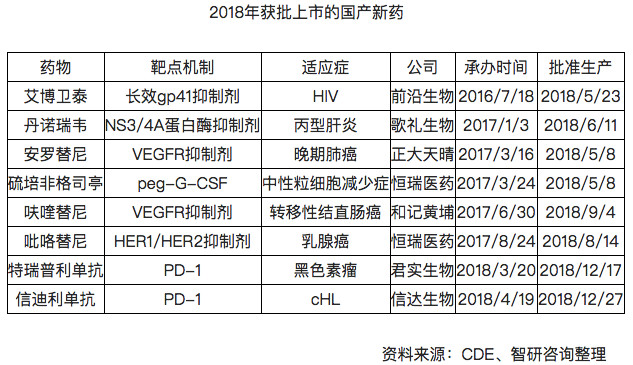
▍盤底2018年上市新藥
随着國務院出台政策,要求“加快境内外抗癌新藥注冊審批,滿足患者急需”,近年來,我國新藥獲批數量有了很大的提升。據國家藥監局數據,僅2018年就批準了18個抗癌新藥上市。
2018年,我國生物醫藥領域獲得了突破性的發展,中國創新藥産業也開始爆發。據智研咨詢統計,2018年全年已有8個重磅國産新藥獲批上市。
國産新藥集中獲批上市,主要有兩方面的原因:
一方面,是《關于深化審評審批制度改革鼓勵
藥品醫療器械創新的意見》的出台,縮短了新藥臨床試驗審批流程。在2018年7月,國家藥監局對藥物臨床試驗審評審批做出調整:自申請受理并繳費之日起60日内,申請人未收到國家藥監局藥品審評中心否定或質疑意見的,可按照提交的方案開展試驗;
另一方面,我國生物
醫藥公司長期積累的技術經驗有助于新藥研發效率的提升,促使我國國産新藥申請數量的增長。
我國醫藥
企業長期的新藥研發投入在近幾年逐步呈現出良好的成果表現,國産新藥臨床申請規模的加速提升也體現了我國新藥研發實力的增強,在國内醫藥市場中,國産藥市場以及進口替代市場有望獲得可觀的成長空間。
國家藥監局表示,将進一步深化藥品審評審批制度改革,持續加大工作力度,繼續加快落實境外新藥上市的系列政策措施,同時加快國産抗癌新藥注冊審批速度,更好地滿足患者臨床需求。
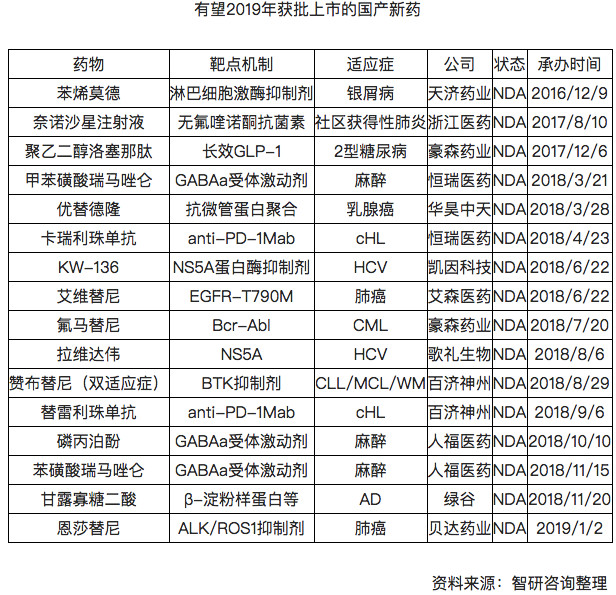
可以預見,2019年國産創新藥的獲批數量,或将進一步增多。