2018年上半年共納入了優先審評的藥品達到144個,其中不乏甲苯磺酸瑞馬唑侖這樣的重磅産品。
根據國家食品藥品監督管理總局藥品審評中心(CDE)披露的數據,2018年第二季度一共将3批100個藥品納入了優先審評名單,一共涉及到65個品種的藥品和47家公司。
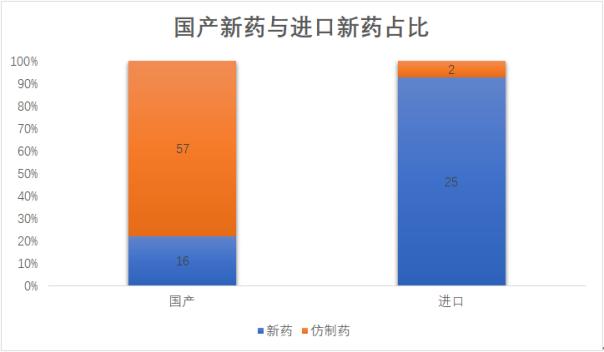
據統計,在這100個藥品申請中,化藥和生物制品分别有81個和19個,仿制藥和新藥分别有59和41個,國産藥和進口藥分别有73個和27個。
國産藥品和進口藥品中,新藥申請的占比分别約為0.22和0.93,國産藥品中新藥申請的占比仍然遠低于進口藥品。
與2018年Q1的44個藥品相比,Q2納入優先審評的藥品數量增長了127%。至此,2018年上半年新納入優先審評的藥品共達到了144個,較去年同期增長了33%。其中,Q2新納入優先審評的國産新藥申請16個,與Q1持平。
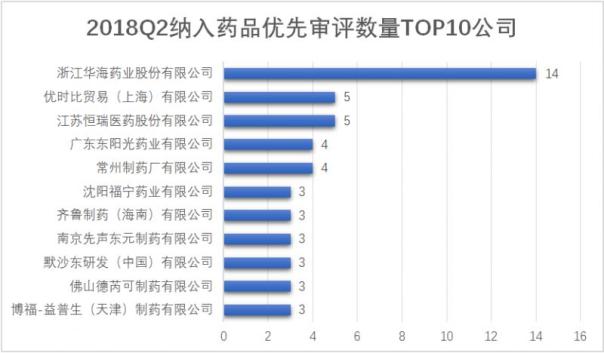
從申請公司來看,華海藥業以14個仿制藥生産申請在數量上遙遙領先,相當于第二名恒瑞醫藥的近三倍;恒瑞醫藥以5個藥品納入優先審評位列第二,同時優時比貿易(上海)有限公司也有5個進口新藥申請被納入優先審評,包括一個生物制品(培塞利珠單抗注射液)和四個化藥(拉考沙胺片)。
從藥品品種來看恒瑞醫藥的5個藥品受理号中,包含了2個化學仿制藥生産申請、2個化學新藥生産申請和1個生物制品新藥生産申請。其中的化學新藥正是恒瑞醫藥有一個“10億級”潛力新藥甲苯磺酸瑞馬唑侖。甲苯磺酸瑞馬唑侖是恒瑞的1.1類新藥,用于患者的靜脈麻醉,在2017年6月獲CFDA批準進入Ⅲ期臨床,2018年3月甲苯磺酸瑞馬唑侖及其注射劑均申報生産,成為2018年以來首個申報生産的國産1類化學新藥,而此次也順利被納入優先審評。
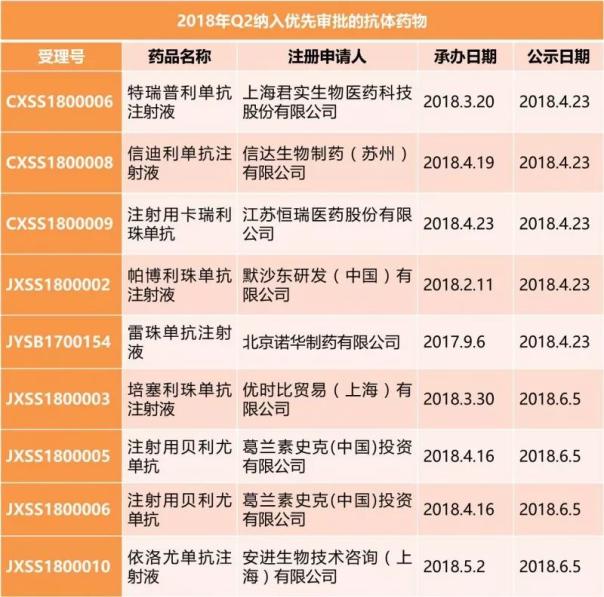
恒瑞醫藥另一款申請生産的新藥為注射用卡瑞利珠單抗,是一款以免疫檢測點為靶點的抗體藥,是抗體藥領域目前最為重要的一類藥物。除恒瑞醫藥的單抗之外,2018年Q2還有另外8個單抗藥物也被納入優先審評,包括了君實生物的特瑞普利單抗注射液和信達生物的信迪利單抗注射液這兩個國産新藥。
此外,由默沙東生産的九價人乳頭瘤病毒疫苗(即HPV疫苗,可用于預防90%的宮頸癌和疣)也進入了新藥生産申請名單,這也意味着或許不久在内地也能接種九價疫苗了。
從納入優先審評的理由來看,2018年Q2有10個罕見病相關藥品被納入名單(由于在CDE官網未查到第三十批的公示名單,因此顯示公示日期為6月13日的10個藥品未查到入選理由)。
治療血友病的A類新藥注射用重組人凝血因子Ⅷ-Fc融合蛋白于2018年3月9日獲CDE受理,該藥由于開封制藥在2017年11月被輔仁藥業并購而被收入了輔仁藥業旗下,這種藥物利用Fc融合技術提高了凝血因子Ⅷ的半衰期,具有提供長效止血功能、降低給藥頻率的潛力。
而博雅生物、康寶生物的人凝血因子Ⅷ也被納入優先審評,根據CDE數據顯示,CDE目前受理的人凝血因子Ⅷ共有28個,其中申請臨床的有19個,上市申請9個。而根據CFDA數據庫顯示,目前已經獲批上市的國産人凝血因子Ⅷ有21個,分别來自華蘭生物、上海萊士、泰邦生物、國藥集團上海血液制品、綠十字等公司。
此外,賽諾菲旗下用于治療複發性多發硬化症的小分子口服罕見病藥物特立氟胺片和益普生旗下用于治療肢端肥大症的生長抑素類似物醋酸蘭瑞肽緩釋注射液(預充式)也因用于治療罕見病而被納入優先審評。
泰格醫藥
代理的Inebilizumab注射液的臨床申請因“罕見病國際多中心臨床試驗”這一理由而被納入優先審評,該藥由阿斯利康旗下MedImmune公司負責開發,于2017年3月獲得了歐洲
藥品管理局(EMA)授予的用于治療視神經脊髓炎譜系
疾病(NMOSD)的孤兒藥資格認定。
兒童用藥方面,成都歐林生物的A群C群腦膜炎球菌多糖結合疫苗、長春百克生物的鼻噴凍幹流感減毒活疫苗、新疆特豐藥業的水合氯醛口服溶液和直腸用溶液、北京華衛
醫藥的小兒鹽酸頭孢卡品酯顆粒以及禮來的鹽酸托莫西汀口服溶液被納入優先審評。